| Rev.131017 |
|
||
| (酸化ストレス研究用試薬) | ||
| 【リン脂質の酸化損傷マーカー】 | ||
|
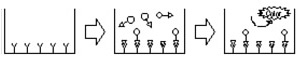
| 【測定原理】 | ||
|
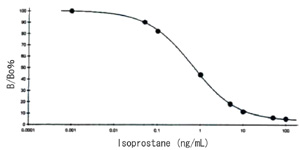
| 【製品仕様】 | ||||||||||||||
|
| 【キットの構成】 | |||||||||||||||||||||
|
|||||||||||||||||||||
| 【測定手順】 | ||||||||||||||||||||
|
||||||||||||||||||||
| 【参考文献】 | ||||||
|
【製造元】:Northwest Life Science Specialities LLC, USA |
| 【スタンダードの調製方法】 | ||||||||||||||||||
|
||||||||||||||||||
| 【サンプルの前処理(固相抽出)】 | ||||||||||||||||
|
||||||||||||||||
| 【サンプルの前処理(加水分解処理)】 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 【ご注意】本製品は研究用試薬です。研究以外の用途(臨床検査/診断/医療行為等)には使用できません。 |