| ホーム > プロトコル・使用説明書・MSDS > 「New 8-OHdG Check」ELISAキット測定法のチェックポイント | Rev.061219 |
 |
| 「New 8-OHdG Check」ELISAキットはどなたでも簡単にご利用頂けます。ご使用にあたってのチェックポイントをご紹介いたします。 他のELISAキットにも共通する部分もありますので、より精度の高いデータを得るための参考にして頂ければ幸いです。 ※「高感度8-OHdG Check」など製品によってそれぞれプロトコルや反応条件が異なります。 ご使用の前にキットに同梱されている使用説明書を よくお読みください。 |
| 【「New 8-OHdG Check」ELISAキットの使用手順】 | ||
|
| 【固相化プレートの準備】 | ||
|
| 【サンプル分注】 | ||
|
| 【1次抗体分注】 | ||
|
|
| 【1次抗体反応】 | ||
|
|
| 【洗浄】以下の手順を3回繰り返します。 | ||
|
|
|
|
|
| 【2次抗体分注】 | ||
|
|
| 【2次抗体反応】 | ||
|
| 【洗浄】以下の手順を3回繰り返します。 | ||
|
|
|
|
|
|
| 【発色試薬分注】 | ||
|
|
| 【発色反応】 | ||
|
|
|
|
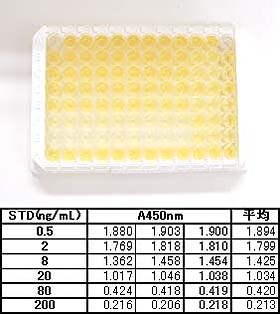
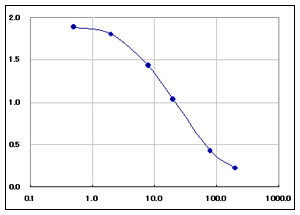
| 【典型的な検量線】 | ||
|
||
| 【トラブルシューティング】 | ||||||||||||||
|
||||||||||||||
|


 ■分注前に1次抗体試薬を調製しておきます。
■分注前に1次抗体試薬を調製しておきます。

 ■プレートをシールします。
■プレートをシールします。
 ■プレートからシールを剥がします。
剥がしたシールはもう一度使いますので保存しておきます。シールに液滴が付いている場合にはキムワイプ等で取り除いてください。
■プレートからシールを剥がします。
剥がしたシールはもう一度使いますので保存しておきます。シールに液滴が付いている場合にはキムワイプ等で取り除いてください。